 Pavel Kroupka 08.07.2021
Pavel Kroupka 08.07.2021 Podstawowe cegiełki materii - eksperyment Ernesta Rutherforda
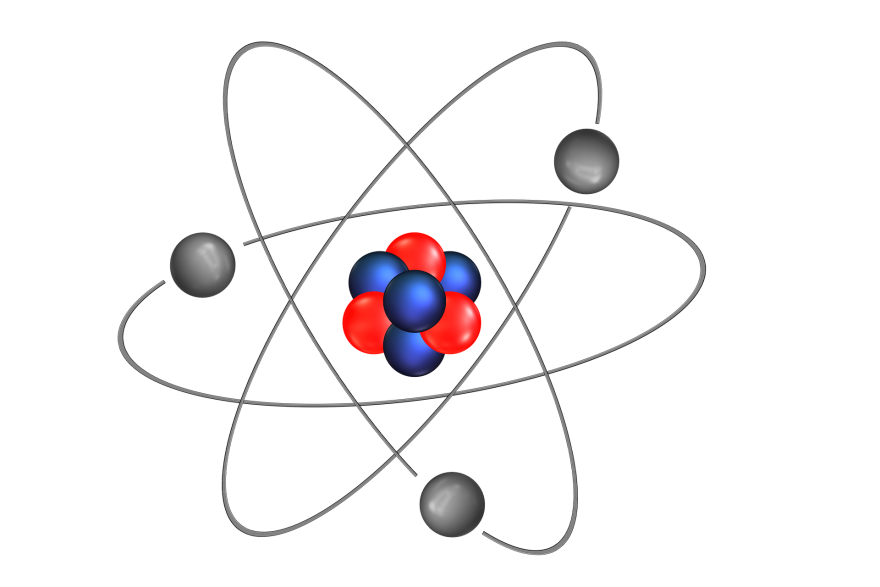
Idea świata składającego się z malutkich cegiełek obecna była już w Starożytności. Pomysł dzielenia materii aż do granicy niepodzielnej drobiny - “átomos” - wydaje się zresztą jak najbardziej naturalnym pomysłem. Starożytne atomy rozwiązywały nękający ówczesnych myślicieli problem bezustannej zmiany. Panta rhei - wszystko płynie, miał powiedzieć Heraklit z Efezu obserwując prawa, którym podlegała przyroda i wszystkie sprawy świata. Owa płynność musiała jednak zachodzić względem jakiegoś trwałego standardu. Trwałe i niezmienne miały być atomy. Płynne, nietrwałe i ulotne, ich wzajemne przestrzenne relacje.
Atomizm Demokryta i Epikura
Leukippos i Demokryt stworzyli teorię budowy materii, która jest bardzo konkretna: świat zbudowany jest z próżni i wypełniających ją trwałych, aczkolwiek niewidocznych, drobiazgów - atomów. Demokryt przyznawał atomom kształt, położenie i porządek, a wielość ich połączeń tworzyła różnorodność materii. Nieco odmienny atomizm Epikura wskazywał na cząstki składowe atomu, których ułożenie było odpowiedzialne za występowania różnic w wielkościach atomów. Cała materia była tu wypadkową przypadkowego ruchu atomów. Ruch ten tłumaczył jednak inaczej niż Demokryt. Atomy Demokryta opadały z góry na dół z odmienną prędkością wynikającą z różnej wielkości, dając asumpt do zderzeń, połączeń i rozłamów. Atomy Epikura obdarzone zostały ciężarem, który odpowiedzialny był za bezustanne poruszanie. Kierunek ruchu w obu koncepcjach był taki sam, co jednak w przypadku myśli Epikura nie stwarzało przyczynku do wzajemnych oddziaływań, i tym samym materialnych przemian, gdyż prędkość opadających atomów nie różniła się. Wprowadzenie odchyleń (parenklizy) od pionowego spadku było zatem koniecznością dającą możliwość interakcji z innymi poruszającymi się atomami. Cechy materii Demokryt wywodził z rodzaju składających się na nią atomów, Epikur utożsamiał ją ze sposobem ułożenia niepodzielnych cząstek.
Także Lukrecjusz, rzymski poeta, przekonuje nas, iż materia jest niezniszczalna, a jedne jej formy tylko przekształcają się w inne. Z literackim wdziękiem przywołuje materialny, choć niewidoczny wiatr, którego podmuchy zawierają wiele mikroskopijnych drobinek. Tymi drobinkami tłumaczy także rozchodzenie się zapachu, ciepła i dźwięku. Zgadza się z Demokrytem - istnienie próżni stanowi warunek tego ruchu. Dla Lukrecjusza ludzkie działania to tylko zjawiska nieważne i powierzchowne. To co istotne kryło się pod tą powierzchnią - niezniszczalne atomy rozwieszone w przestrzeni materii.
Nowożytne badania atomu
Starożytnym atomom Isaac Newton przypisał atrybuty ciał istniejących w skali makro: masę, ciężar, zdolność wywierania nacisków. Daniel Bernoulli wykorzystując te spekulacje tłumaczył, jak gaz zbudowany z atomów wywiera ciśnienie na ścianki zbiornika. Rozważania obu naukowców miały jednak charakter spekulatywny. Empiryczne dowody na istnienie atomów dostarczył John Dalton (teoria atomistycznej budowy materii - 1808), a związane były one z równymi proporcjami mas jednorodnych substancji chemicznych. Teoria Daltona umocniła atomizm wprowadzając nowe elementy tej koncepcji: poszczególne pierwiastki posiadały własny rodzaj atomu o identycznych właściwościach, zaś cząsteczki związków chemicznych składały się ze skończonej liczby atomów różnych pierwiastków. Teoria Daltona funkcjonowała bardzo dobrze do końca XIX wieku pomimo rosnącej liczby odkrywanych pierwiastków. Koniec stulecia przyniósł pewną komplikację w kontekście niepodzielności atomu.
Promieniotwórczość oraz “ciasto z rodzynkami”
Odkryto wówczas promieniotwórcze atrybuty pewnych rodzajów atomów, tj. ich zdolność do emisji cząstek i promieniowania elektromagnetycznego. Promieniotwórczość wskazywała na istnienie drobniejszych cząstek w strukturze atomu. Cząstki określone zostały promieniowaniem alfa, beta i gamma. Okazało się, że promienie α i β, ulegają odchyleniu w polu elektrycznym i magnetycznym, co wskazywało na posiadanie ładunku elektrycznego. W przypadku promieniowania alfa był to ładunek dodatni. W 1908 roku odkryto, że jest on związany z jądrami helu - na ten rodzaj promieniowania składały się dwa protony i dwa neutrony. Promieniowanie beta odchylało się w polu przeciwnie do cząstek alfa, co wskazywało na jego ujemny ładunek. Cząstki promieniowania beta okazały się być elektronami. Promieniowanie gamma odkryte przez Paula Villarda w 1900 roku nie posiadało ładunku i stanowiło fale elektromagnetyczne o bardzo małych długościach i wysokiej energii. Wszystkie rodzaje promieniowania musiały w jakiś sposób zawierać się w atomach określonych rodzajów.
W 1904 roku Joseph John Thomson zasugerował możliwość istnienia wielu elektronów wewnątrz struktury atomu. Chodziło tu o wyjaśnienie obojętnego ładunku większości atomów w kontekście odpowiednio naładowanej emisji promieniowania. Thomson stworzył model atomowej kuli wypełnionej dodatnim płynem neutralizującym oddziaływanie zanurzonych w nim elektronów. Powstał model zwany “ciastem z rodzynkami”. Aby zachować równowagę sił elektrostatycznych elektrony musiały być tutaj rozmieszczone symetrycznie względem środka atomu - w przypadku dużej liczby elektronów pojawiały się problemy matematyczne, którym tylko częściowo zaradzić miała koncepcją odpowiednio dużej liczby elektronów pogrupowanych w płaszczyznach współśrodkowych w stosunku do dodatniej kuli. Siła odśrodkowa pojawiająca się w kontekście poruszania elektronów sprawia, iż elektrony zwiększając swoją prędkość mogą opuścić wnętrze kuli doprowadzając do rozpadu atomu.
Eksperyment Rutherforda
Model “ciasta z rodzynkami” przetrwał do roku 1910 kiedy to został zakwestionowany dzięki doświadczeniu Rutherforda. Eksperyment przeprowadzony przy współudziale Hansa Geigera i Ernesta Marsdena był próbą weryfikacji modelu Thomsona i polegał na bombardowaniu cienkiej złotej folii cząstkami alfa w celu określenia stopnia przenikalności tejże folii przez cząsteczki promieniowania - dla dużych cząstek alfa folia nie powinna stanowić żadnej bariery (cząstki alfa są ciężkie, a ładunek atomów złota według Thomsona powinien być rozproszony). Tymczasem meldunek, który otrzymał Rutherford od Geigera mówił nie tylko o przenikaniu promieniowania przez folię, ale także o znacznym odchyleniu toru wielu wypromieniowanych cząstek po kontakcie z folią, oraz, co najbardziej zdziwiło naukowców, odbiciu od folii i powrocie wielu z nich do źródła. 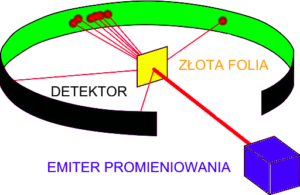
Elektron jest około 8 tysięcy razy mniejszy od cząsteczki alfa, przez co nie mógł być odpowiedzialny za zmianę kierunku lotu wypromieniowanej cząstki. Również sama masa atomu nie mogła zmienić kierunku lotu, jeśli jak sądzono cała rozłożona była równomiernie w jego objętości. Wyglądało tak, jakby większość masy atomu złota skupiona była w jednym stabilnym punkcie - jądrze atomowym. I tylko natrafiając na owo masywne jądro trajektoria cząstek alfa mogła ulec odchyleniu.
Bombardując złotą folię cząsteczkami alfa Rutherford udowodnił błąd w koncepcji Josepha Thomsona. Elektrony nie były na tyle masywne, ani nie posiadały odpowiednio dużego ładunku (nawet grupowane w płaszczyznach), aby oddziaływać z cząstkami alfa; nie mogło w ten sposób oddziaływać także rozproszone równomiernie „ciasto” o postulowanym ładunku dodatnim. Cząstki alfa musiały bezpośrednio podlegać zderzeniom z atomowym jądrem i w efekcie odbiciom w kierunku źródła promieniowania, albo przelatując w bliskiej odległości od środka ulegać oddziaływaniom z jego dodatnim ładunkiem zmieniając trajektorię lotu. Sporo cząstek przenikało jednak przez folię, co wskazywało na niewielkie rozmiary masywnego środka w porównaniu do wymiarów całego atomu. To z kolei sugerowało obecność ogromnych pustych obszarów wewnątrz struktury atomu. Eksperyment Rutherforda wskazywał więc na istnienie skoncentrowanego i masywnego środka z dodatnim ładunkiem wokół którego przestrzeń wypełniały orbity elektronów. Przy czym średnica jądra, jak się później okazało, swym rozmiarem miała się tak do średnicy całego atomu jak główka szpilki do stadionu. Pusta przestrzeń postulowana przez starożytnych badaczy okazała się być nie tylko na zewnątrz atomów, ale także wypełniać wnętrze ich struktury.
Model Rutherforda - jądro z krążącymi po orbitach elektronami - został w 1913 uzupełniony przez Nielsa Bohra, jednak sama jego koncepcja była wciąż aktualna i stanowiła znakomity punkt wyjścia dla różnych późniejszych rozważań. Podstawowe cegiełki materii przestały być teoretycznymi konstruktami. Atomy zaczęły odsłaniać swoje wnętrza, a odkryta pustka tworzących je przestrzeni przywołała myśl Demokryta, gdzie byt nie był bardziej realny niż niebyt.
 info@iviter.pl
info@iviter.pl








Napisz komentarz (bez rejestracji)